|
|
|
|
|
PROGETTO FIUME PO Acquisizione di dati, sperimentazione di metodologie geofisiche e valutazione del loro impatto ambientale sul Fiume Po |
||
|
|
|
|
|
PROGETTO FIUME PO Acquisizione di dati, sperimentazione di metodologie geofisiche e valutazione del loro impatto ambientale sul Fiume Po |
||
4.1 INTRODUZIONE 4
4.1.1 Obiettivi della ricerca 5
4.1.2 Area del lavoro 6
4.1.3 Periodo di lavoro e personale 7
4.2 METODOLOGIE OPERATIVE E STRUMENTAZIONI 8
4.2.1 Sorgente energetica utilizzata per gli esperimenti: Air gun 8
4.2.2 Scelta delle specie ittiche e degli individui 8
4.2.3 Scelta delle gabbie 25
4.2.4 “Set up” dell’esperimento 27
4.2.5 Allestimento dei preparati per l’indagine istopatologica 33
4.3 RISULTATI 35
4.3.1 Mortalità osservata 35
4.3.2 Aspetti comportamentali, clinici e necroscopici rilevati immediatamente dopo l’energizzazione 36
4.3.2.1 Pesci di controllo 36
4.3.2.2 Gabbie di fondo 39
4.3.2.3 Gabbie di superficie a 25 m dall’air gun 40
4.3.2.4 Gabbie di superficie a 50 m dall’air gun 40
4.3.3 Aspetti microscopici rilevati sui pesci immediatamente dopo l’ energizzazione 41
4.3.4 Aspetti macro- e microscopici rilevati dopo 7 giorni dall’energizzazione 47
4.3.5 Aspetti macro- e microscopici rilevati dopo 15 giorni dall’energizzazione 50
4.4 CONCLUSIONI 51
La costante necessità di fonti di energia per le attività antropiche si indirizza, fra l’altro, alla ricerca di nuovi giacimenti, in particolare per l’estrazione di petrolio o gas naturale. Tali indagini necessitano di ricerche geologiche, effettuate mediante rilievi sismici che utilizzano strumenti in grado di emettere onde elastiche che attraversano il sottosuolo, e dopo essere state riflesse dai diversi strati ritornano in superficie, dove vengono registrate da geofoni. La emissione di onde sismo-elastiche in acqua è possibile in diversi modi, mediante la conversione di energia chimica, elettrica, pneumatica. In particolare, questo ultimo metodo viene implementato mediante il rilascio nel tempo quanto più breve possibile di un volume predeterminato di aria compressa in una camera sommersa (“air-gun”). La perturbazione del mezzo e il ristabilimento dell’equilibrio idrostatico generano il segnale sismico. L’air gun è la sorgente di energia più frequentemente utilizzata nell’ambiente marino.
L’utilizzo degli strumenti che producono le onde sismiche e l’eventuale impatto negativo sugli organismi acquatici ha sempre provocato la preoccupazione degli operatori della pesca, e, più in generale, degli ambientalisti. Tale perplessità risulta legittima vista la scarsità delle informazioni a disposizione, in qualche caso contrastanti tra di loro.
Pare che i pesci modifichino il loro comportamento a causa delle onde emesse da apparecchiature come l’air gun (Tavolga et al. 1981). Inoltre, risulta che la distribuzione spaziale dei pesci si alteri lungo il percorso della nave dalla quale vengono effettuate le prospezioni geologiche mediante l’air gun (Dalen & Raknes, 1985). Infine, si è evidenziata una riduzione della resa di pesca nelle aree in cui si svolgono le operazioni (Sverdrup et al. 1994).
L’ambiente acquatico è caratterizzato da un’ampia varietà di parametri, che influenzano l’omeostasi, parametro essenziale per la crescita e la riproduzione dei pesci (Roberts, 1989). Per omeostasi si intende il mantenimento dell’equilibrio delle funzioni dell’organismo e delle caratteristiche chimico-fisiche del suo ambiente interno, al variare di quelle dell’ambiente esterno. Tale processo è sotto il controllo dei sistemi neurovegetativi ed ormonali.
È facilmente comprensibile come i pesci siano costretti a subire, più che ogni altro vertebrato, l’influenza dell’ambiente in cui vivono. Quando l’influenza risulta dannosa, essi non possono sfuggirle che in maniera assai limitata. Un capitolo molto importante in ittiopatologia, è quello designato con il termine generale (ed in accordo con la letteratura) di ‘malattie non parassitarie’ o non condizionate da agenti eziologici o più esattamente ‘non contagiose’. Alcune patologie come traumi, disturbi da acqua acida o alcalina, sbalzi di temperatura, avvelenamenti (da scarichi urbani, agricoli o industriali) possono derivare da vari tipi di “stress” ambientali.
Il fatto che gli “stress” ambientali siano in grado di ridurre la resistenza dei pesci di fronte alle malattie, limitandone in modo anche significativo la sopravvivenza, è fenomeno ben noto (Haley et al. 1967; Schäperclaus, 1954; Snieszko, 1962, 1964; Wedemeyer, 1971). Il termine “stress” frequentemente viene confuso con l’agente (fattore) che lo provoca. Una tra le più accreditate definizioni è quella data da Brett (1958), che definisce lo stress come la condizione dovuta all’ambiente o a fattori ambientali che discostano le normali risposte adattative di un animale, compromettendone la sopravvivenza.
La maggioranza degli studi sugli effetti che i mezzi utilizzati per le prospezioni geologiche hanno sulla fauna ittica si riferiscono all’ambiente marino, mentre mancano analoghe ricerche nei fiumi. Per quanto concerne l’Italia, le campagne sperimentali sono state eseguite in mare Adriatico da parte dell’ENI, che recentemente ha esteso simili indagini all’ambiente fluviale.
L’esperimento aveva lo scopo di ottenere informazioni sul disturbo generato dall’air gun sulla fauna ittica, rappresentata da cinque specie ittiche d’acqua dolce, scelte come specie bersaglio perché rappresentative dell’ambiente di fondo, della colonna d’acqua e della riva.
I punti sui quali l’indagine doveva far luce erano:
effetti acuti (morte immediata e lesioni gravi);
effetti cronici, che si manifestano a medio-lungo termine (danni anatomici ad occhi, branchie , vescica natatoria, fegato, milza, rene, cuore);
eventuale diversità di impatto in relazione alla taglia;
effetto sul comportamento;
eventuale diversità d’impatto in relazione alla distanza dall’air-gun.
L’esperimento si è svolto in località Isola di Polesine Camerini, in corrispondenza di un attracco presso la centrale idroelettrica di Pila, come illustrato nella figura seguente.
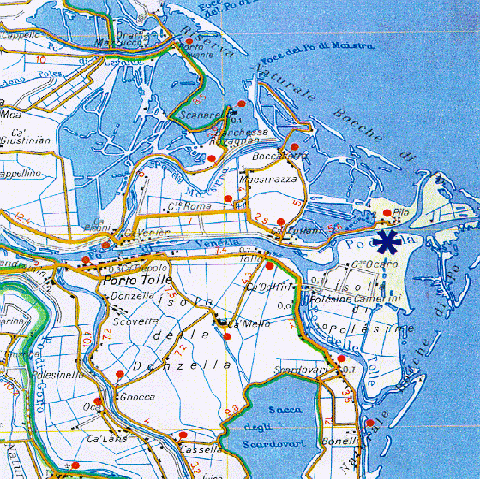
Fig. 4.1.2 - Ubicazione del test di impatto sulla fauna ittica
Le operazioni, svolte durante la giornata del 6 dicembre 1996, sono state condotte, in collaborazione con i tecnici della società contrattista G.A.S., da ricercatori del Dipartimento di Biologia Evolutiva dell’Università degli Studi di Ferrara.
La squadra che ha condotto il lavoro era composta da due operatori ai cannoni diretti da un responsabile G.A.S., il responsabile scientifico del Dipartimento di Biologia dell’Università degli Studi di Ferrara ed otto ricercatori della stessa Università che hanno curato l’interpretazione e la elaborazione dei dati raccolti.
Le caratteristiche tecniche della sorgente di energia utilizzata sono le seguenti:
|
Pressione operativa: |
2000 psi |
|
Modalità operative: |
Armonica 210 Cubic Inch 105/105 |
Con il vincolo della effettiva disponibilità di un numero sufficiente di esemplari al momento dell’esperimento, la scelta delle specie ha tenuto in considerazione quelle maggiormente diffuse e/o di interesse commerciale nel tratto terminale del fiume Po, con preferenza per quelle a comportamento bentonico, perché di norma più stanziali e meno pronte alla fuga.
I lotti di pesce sono stati procurati, nella settimana antecedente l’esperienza, dalla pesca professionale, previo contatto con cooperative locali (Pila). I pesci sono stati forniti vivi ed in buone condizioni e stabulati in due gabbie di stoccaggio, in prossimità del sito della esperienza. Lo stoccaggio aveva lo scopo di permettere ai pesci di superare lo stress da cattura, eliminando nel contempo gli esemplari morti o in manifeste cattive condizioni di salute.
Le specie a comportamento prevalentemente bentonico utilizzate nella presente ricerca sono state: Anguilla anguilla (anguilla), Silurus glanis (siluro), Ictalurus melas (pesce gatto), Cyprinus carpio (carpa). Il carassio, Carassius carassius, è stato scelto come specie indicatrice di un comportamento più tipicamente ripario.
L'esperimento ha interessato un totale di 529 pesci (Fig. 4.2.2a e b), rispettivamente:
103 carassi (le misure biometriche relative sono riportate nella Tab. 4.2.2b);
63 carpe (Tab. 4.2.2c);
127 pesci gatto (Tab. 4.2.2d);
105 siluri (Tab. 4.2.2e);
131 anguille (Tab. 4.2.2f).
In base alla dimensione degli animali disponibili si sono distinte due taglie, denominate ‘piccola’ e ‘grande’: i valori medi (± deviazione standard) delle lunghezze totali e dei pesi sono riportati nella seguente Tabella 4.2.2a.
|
Specie |
Taglia piccola |
Taglia grande |
|
CARASSIO |
n = 57 |
n = 46 |
|
L.T. (cm) |
21.53 ± 2.91 |
29.13 ± 4.01 |
|
Peso (g) |
209.9 ± 80.0 |
522.3 ± 277.6 |
|
CARPA |
n = 30 |
n = 33 |
|
L.T. (cm) |
20.50 ± 2.51 |
35.02 ± 9.93 |
|
Peso (g) |
153.2 ± 61.2 |
788.3 ± 666.8 |
|
PESCE GATTO |
n = 42 |
n = 85 |
|
L.T. (cm) |
21.79 ± 1.75 |
24.79 ± 1.01 |
|
Peso (g) |
124.8 ± 26.2 |
182.3 ± 31.1 |
|
SILURO |
n = 27 |
n = 78 |
|
L.T. (cm) |
39.99 ± 6.70 |
73.69 ± 12.57 |
|
Peso (g) |
430.3 ± 221.2 |
2852.6 ± 1423.3 |
|
ANGUILLA |
n = 27 |
n = 104 |
|
L.T. (cm) |
51.93 ± 7.52 |
73.68 ± 8.92 |
|
Peso (g) |
295.0 ± 122.2 |
843.9 ± 341.5 |
Tab. 4.2.2a - Dimensioni delle specie utilizzate
Fig. 4.2.2a - Specie ittiche del fiume Po
Fig. 4.2.2b - Censimento degli esemplari da utilizzare durante la prova
Tabella 4.2.2b - Lunghezze (cm) e pesi (gr) dei carassi.
CARASSIO (Carassius carassius)
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
32.5 |
27.4 |
601.5 |
|
40 |
21.8 |
18.5 |
196.8 |
|
79 |
12.8 |
11.2 |
40 |
|
2 |
37 |
30.8 |
1067.3 |
|
41 |
25 |
20 |
256.9 |
|
80 |
25,8 |
20.9 |
115 |
|
3 |
18.2 |
14.5 |
105.2 |
|
42 |
20 |
18.5 |
195.9 |
|
81 |
19.8 |
16 |
150 |
|
4 |
15.3 |
12.5 |
60.9 |
|
43 |
23.5 |
20.5 |
295 |
|
82 |
23.9 |
19.4 |
260 |
|
5 |
26 |
22 |
429.7 |
|
44 |
23 |
19.5 |
245 |
|
83 |
25.6 |
21 |
325 |
|
6 |
23.8 |
19.5 |
228 |
|
45 |
25.6 |
21.3 |
330 |
|
84 |
19.8 |
16.2 |
145 |
|
7 |
24.3 |
21 |
291.2 |
|
46 |
26.8 |
21.2 |
335 |
|
85 |
20.5 |
17.2 |
170 |
|
8 |
20 |
15.8 |
155 |
|
47 |
31 |
27.4 |
690 |
|
86 |
24.2 |
20.5 |
315 |
|
9 |
16 |
11.9 |
136 |
|
48 |
14.8 |
12.6 |
70 |
|
87 |
23 |
20.9 |
365 |
|
10 |
16 |
13 |
71.7 |
|
49 |
23 |
20 |
280 |
|
88 |
30.1 |
25.9 |
605 |
|
11 |
34.5 |
29.4 |
778.4 |
|
50 |
22 |
17 |
175 |
|
89 |
23.6 |
19.3 |
250 |
|
12 |
37.5 |
31.9 |
1070.9 |
|
51 |
32 |
27.5 |
810 |
|
90 |
20.5 |
16.7 |
160 |
|
13 |
33.7 |
28.8 |
768.8 |
|
52 |
33 |
28 |
830 |
|
91 |
27.2 |
22.5 |
440 |
|
14 |
27 |
23 |
410.5 |
|
53 |
35 |
30 |
1075 |
|
92 |
22,6 |
18.5 |
210 |
|
15 |
26.2 |
22.4 |
338.5 |
|
54 |
30 |
25.8 |
520 |
|
93 |
25,8 |
21.4 |
365 |
|
16 |
25.2 |
20.9 |
308.4 |
|
55 |
22 |
19 |
245 |
|
94 |
21,5 |
17.1 |
175 |
|
17 |
25.1 |
20.9 |
288.1 |
|
56 |
23 |
20.5 |
285 |
|
95 |
25 |
21 |
340 |
|
18 |
25.3 |
20.8 |
277.3 |
|
57 |
23.5 |
20.5 |
295 |
|
96 |
28 |
23 |
495 |
|
19 |
25.7 |
22.4 |
290.6 |
|
58 |
17.4 |
14.2 |
90 |
|
97 |
22.5 |
18 |
229 |
|
20 |
33 |
28 |
767.2 |
|
59 |
23.2 |
18.2 |
190 |
|
98 |
26.5 |
22.3 |
390 |
|
21 |
33.7 |
28.2 |
794 |
|
60 |
22.9 |
18.2 |
205 |
|
99 |
21 |
17 |
165 |
|
22 |
33.4 |
28.7 |
758.7 |
|
61 |
24.5 |
20.2 |
305 |
|
100 |
20 |
16.5 |
150 |
|
23 |
32.4 |
28 |
723.3 |
|
62 |
30.6 |
26.4 |
665 |
|
101 |
17.2 |
14.3 |
95 |
|
24 |
25 |
21.1 |
311.5 |
|
63 |
32 |
27 |
745 |
|
102 |
21.5 |
18.4 |
140 |
|
25 |
24 |
20.4 |
298.6 |
|
64 |
23 |
19.5 |
270 |
|
103 |
23,7 |
19.2 |
245 |
|
26 |
33 |
28 |
733 |
|
65 |
22.8 |
20.5 |
290 |
|
|
|
|
|
|
27 |
25 |
21.2 |
263.3 |
|
66 |
15,6 |
11.5 |
45 |
|
|
|
|
|
|
28 |
23 |
18 |
192 |
|
67 |
31,7 |
26.9 |
705 |
|
|
|
|
|
|
29 |
20 |
16.2 |
136.8 |
|
68 |
22.8 |
18.7 |
250 |
|
|
|
|
|
|
30 |
24.9 |
20 |
260.4 |
|
69 |
24.3 |
21.5 |
335 |
|
|
|
|
|
|
31 |
25.2 |
20.5 |
257 |
|
70 |
38.7 |
31.8 |
1270 |
|
|
|
|
|
|
32 |
24 |
19.2 |
234 |
|
71 |
24,8 |
21.3 |
325 |
|
|
|
|
|
|
33 |
22.2 |
17.5 |
184.1 |
|
72 |
19,4 |
15.8 |
145 |
|
|
|
|
|
|
34 |
25 |
20.3 |
260.2 |
|
73 |
23 |
19.8 |
290 |
|
|
|
|
|
|
35 |
27.8 |
22.7 |
447.7 |
|
74 |
27,3 |
23.5 |
470 |
|
|
|
|
|
|
36 |
25.7 |
20.5 |
151.8 |
|
75 |
27 |
23 |
465 |
|
|
|
|
|
|
37 |
25.6 |
20.8 |
284.6 |
|
76 |
24,8 |
20 |
260 |
|
|
|
|
|
|
38 |
24.2 |
19.2 |
263.9 |
|
77 |
24 |
20.2 |
290 |
|
|
|
|
|
|
39 |
23.5 |
20.2 |
259.4 |
|
78 |
20.5 |
19.9 |
250 |
|
|
|
|
|
Tabella 4.2.2c - Lunghezze (cm) e pesi (gr) delle carpe
CARPA (Cyprinus carpio)
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
|
|
1 |
21.8 |
17.8 |
163 |
|
33 |
18.8 |
14.9 |
100 |
|
2 |
17 |
14.1 |
72.1 |
|
34 |
20.2 |
16.9 |
145 |
|
3 |
33 |
28.5 |
654,5 |
|
35 |
25.7 |
21.8 |
300 |
|
4 |
41 |
35 |
1124 |
|
36 |
29.7 |
25.7 |
410 |
|
5 |
54 |
45 |
2085 |
|
37 |
19.2 |
17.8 |
180 |
|
6 |
29 |
24.8 |
417.8 |
|
38 |
32.2 |
27.2 |
615 |
|
7 |
22 |
19 |
207.8 |
|
39 |
39.2 |
32.8 |
910 |
|
8 |
24.5 |
20.4 |
254.6 |
|
40 |
33.2 |
28.2 |
705 |
|
9 |
20.5 |
16.8 |
170.8 |
|
41 |
29.4 |
25.8 |
530 |
|
10 |
18 |
15 |
87.7 |
|
42 |
52.5 |
43.9 |
1180 |
|
11 |
30.2 |
25 |
578.3 |
|
43 |
49.2 |
41.5 |
810 |
|
12 |
42.3 |
35.5 |
1184.8 |
|
44 |
54.5 |
48.2 |
2580 |
|
13 |
30 |
25.2 |
426.3 |
|
45 |
25.9 |
22.2 |
200 |
|
14 |
26.9 |
22.4 |
344.3 |
|
46 |
17.6 |
14 |
65 |
|
15 |
21.6 |
19 |
183.6 |
|
47 |
22 |
18.5 |
205 |
|
16 |
20.2 |
16.7 |
134.8 |
|
48 |
26 |
23 |
330 |
|
17 |
39.5 |
32.8 |
1498.7 |
|
49 |
23.6 |
19.8 |
220 |
|
18 |
30 |
25 |
435.2 |
|
50 |
22 |
18.4 |
175 |
|
19 |
28.5 |
23.7 |
475 |
|
51 |
25.7 |
22 |
295 |
|
20 |
24 |
21.5 |
263.8 |
|
52 |
23.9 |
20.2 |
220 |
|
21 |
26 |
21.8 |
273.7 |
|
53 |
30 |
25.9 |
510 |
|
22 |
20.8 |
17.5 |
131 |
|
54 |
17.8 |
14.5 |
90 |
|
23 |
35 |
30 |
645 |
|
55 |
15.7 |
13 |
55 |
|
24 |
31 |
27.8 |
610 |
|
56 |
23.5 |
20 |
245 |
|
25 |
48 |
41 |
1835 |
|
57 |
51.2 |
43 |
2360 |
|
26 |
14.8 |
12,2 |
65 |
|
58 |
24.2 |
20.5 |
215 |
|
27 |
26 |
23.5 |
320 |
|
59 |
23 |
21.2 |
250 |
|
28 |
52 |
43.6 |
1900 |
|
60 |
23 |
21.2 |
250 |
|
29 |
22 |
18.4 |
150 |
|
61 |
19.5 |
15.9 |
155 |
|
30 |
23.8 |
19 |
160 |
|
62 |
19.1 |
15.6 |
105 |
|
31 |
20.1 |
16.1 |
120 |
|
63 |
21.5 |
18.4 |
140 |
|
32 |
18 |
14.4 |
85 |
|
|
|
|
|
Tabella 4.2.2d - Lunghezze (cm) e pesi (gr) dei pesci gatto.
PESCE GATTO (Ictalurus melas)
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
|
|
1 |
26.5 |
23.2 |
254.2 |
|
33 |
24.8 |
19.9 |
145 |
|
2 |
24.2 |
21.4 |
189.9 |
|
34 |
22.8 |
16.9 |
140 |
|
3 |
24 |
20.5 |
166.02 |
|
35 |
26.7 |
23.5 |
245 |
|
4 |
24 |
22 |
185.6 |
|
36 |
24.2 |
21.1 |
150 |
|
5 |
25 |
22.5 |
181.8 |
|
37 |
26.1 |
22.9 |
220 |
|
6 |
23 |
21.5 |
151 |
|
38 |
21.5 |
19.2 |
115 |
|
7 |
24 |
21.6 |
188.5 |
|
39 |
24.7 |
21.6 |
200 |
|
8 |
22.5 |
19 |
132.4 |
|
40 |
23.5 |
20.4 |
150 |
|
9 |
25.5 |
22.5 |
219 |
|
41 |
21.2 |
18.5 |
115 |
|
10 |
25 |
22 |
188.8 |
|
42 |
22.9 |
20.5 |
140 |
|
11 |
24.7 |
21.4 |
184 |
|
43 |
26.4 |
23.5 |
215 |
|
12 |
23.7 |
20.4 |
154.2 |
|
44 |
23.5 |
20.6 |
135 |
|
13 |
23.4 |
20.3 |
143.9 |
|
45 |
23.9 |
20.4 |
160 |
|
14 |
22 |
19.3 |
143.1 |
|
46 |
23.5 |
20.6 |
160 |
|
15 |
22.5 |
19.5 |
127.9 |
|
47 |
25 |
21.9 |
190 |
|
16 |
25 |
21.9 |
184.3 |
|
48 |
22.7 |
19.8 |
150 |
|
17 |
24.5 |
21.7 |
179.1 |
|
49 |
24.8 |
20.5 |
165 |
|
18 |
22.7 |
18.8 |
150.3 |
|
50 |
23.5 |
20.4 |
150 |
|
19 |
23 |
20.8 |
155 |
|
51 |
23.9 |
21.2 |
180 |
|
20 |
22 |
19.5 |
127.6 |
|
52 |
26 |
23.1 |
235 |
|
21 |
22.7 |
19.3 |
137.8 |
|
53 |
23.8 |
20.3 |
140 |
|
22 |
23 |
20.8 |
150 |
|
54 |
21.9 |
19.5 |
140 |
|
23 |
20.8 |
18.5 |
105 |
|
55 |
24 |
21.1 |
155 |
|
24 |
24.7 |
21.3 |
165 |
|
56 |
22.4 |
19.5 |
145 |
|
25 |
21.8 |
18.9 |
120 |
|
57 |
24.1 |
20.7 |
150 |
|
26 |
25.2 |
22.3 |
190 |
|
58 |
26 |
22.8 |
230 |
|
27 |
21.5 |
19.2 |
125 |
|
59 |
20.5 |
17 |
85 |
|
28 |
22 |
19.4 |
130 |
|
60 |
24.5 |
21.3 |
170 |
|
29 |
25 |
22 |
175 |
|
61 |
25.4 |
21.7 |
185 |
|
30 |
20 |
18 |
100 |
|
62 |
23 |
19.8 |
135 |
|
31 |
22.5 |
20.3 |
148 |
|
63 |
26 |
22.3 |
210 |
|
32 |
26 |
23 |
220 |
|
64 |
25.6 |
22.4 |
250 |
Tabella 4.2.2d (continua) - Lunghezze (cm) e pesi (gr) dei pesci gatto.
PESCE GATTO (Ictalurus melas)
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
|
|
65 |
25.8 |
23.6 |
240 |
|
97 |
23.9 |
21 |
170 |
|
66 |
24 |
20.8 |
190 |
|
98 |
24.2 |
20.8 |
145 |
|
67 |
25 |
22.8 |
240 |
|
99 |
23.8 |
21 |
155 |
|
68 |
23.5 |
20.4 |
145 |
|
100 |
24.5 |
21.7 |
195 |
|
69 |
27 |
23.4 |
235 |
|
101 |
26.4 |
23.2 |
155 |
|
70 |
26 |
22.7 |
220 |
|
102 |
24.9 |
21.5 |
190 |
|
71 |
24.3 |
21.2 |
160 |
|
103 |
25.8 |
22.4 |
195 |
|
72 |
24 |
21.3 |
175 |
|
104 |
24.8 |
21.9 |
195 |
|
73 |
26.1 |
22.8 |
210 |
|
105 |
23.4 |
20.3 |
145 |
|
74 |
25 |
20.8 |
185 |
|
106 |
23.3 |
20.3 |
145 |
|
75 |
23.8 |
20.9 |
155 |
|
107 |
24.6 |
22.5 |
170 |
|
76 |
25.7 |
22.3 |
225 |
|
108 |
22.5 |
19.5 |
105 |
|
77 |
25.8 |
20.4 |
210 |
|
109 |
22.6 |
19.5 |
140 |
|
78 |
25.5 |
22.4 |
220 |
|
110 |
26.2 |
23.1 |
220 |
|
79 |
24.3 |
21.1 |
165 |
|
111 |
24.7 |
21.2 |
165 |
|
80 |
25.5 |
22.2 |
210 |
|
112 |
21.9 |
19 |
115 |
|
81 |
21.5 |
18.8 |
130 |
|
113 |
23 |
20 |
150 |
|
82 |
23.2 |
20.4 |
135 |
|
114 |
23.2 |
20.1 |
140 |
|
83 |
22.8 |
20 |
130 |
|
115 |
22.6 |
19.9 |
125 |
|
84 |
24.9 |
21.3 |
180 |
|
116 |
23.9 |
21 |
160 |
|
85 |
24.4 |
20.9 |
160 |
|
117 |
24.2 |
21.3 |
170 |
|
86 |
21.9 |
19.2 |
115 |
|
118 |
28.2 |
25.6 |
105 |
|
87 |
25.3 |
22.2 |
195 |
|
119 |
22.2 |
19.6 |
130 |
|
88 |
23.8 |
21 |
155 |
|
120 |
23 |
20.4 |
140 |
|
89 |
25.3 |
21.7 |
200 |
|
121 |
24 |
20.8 |
165 |
|
90 |
24.6 |
21.2 |
190 |
|
122 |
21.8 |
18.8 |
115 |
|
91 |
21.9 |
19.7 |
125 |
|
123 |
22 |
19.4 |
130 |
|
92 |
21.9 |
18.8 |
115 |
|
124 |
22.4 |
20 |
140 |
|
93 |
25.9 |
22.6 |
210 |
|
125 |
20 |
18 |
100 |
|
94 |
24.8 |
22 |
175 |
|
126 |
17 |
14.8 |
50 |
|
95 |
24.2 |
20.9 |
190 |
|
127 |
13.2 |
11.02 |
20 |
|
96 |
24.8 |
21.7 |
175 |
|
|
|
|
|
Tabella 4.2.2e - Lunghezze (cm) e pesi (gr) dei siluri.
SILURO (Silurus glanis)
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
N°. |
L.T. |
L.S. |
PESO |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
(cm) |
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
79.3 |
74.5 |
3315 |
|
40 |
38.2 |
36.5 |
330 |
|
79 |
50.7 |
47 |
865 |
|
2 |
83.2 |
80 |
4006 |
|
41 |
67.8 |
63.3 |
1675 |
|
80 |
77.5 |
73.2 |
3890 |
|
3 |
47 |
44.3 |
687.3 |
|
42 |
48.2 |
45.2 |
620 |
|
81 |
98 |
96 |
6987 |
|
4 |
58.5 |
55 |
1394.2 |
|
43 |
39.5 |
36.5 |
340 |
|
82 |
72 |
68.8 |
2431 |
|
5 |
56 |
52.5 |
1120 |
|
44 |
49 |
46.3 |
702 |
|
83 |
80.3 |
77.7 |
3000 |
|
6 |
82 |
77 |
3105 |
|
45 |
59 |
55 |
1240 |
|
84 |
73.8 |
70.2 |
3143 |
|
7 |
63 |
59.5 |
2410 |
|
46 |
62.2 |
59 |
1320 |
|
85 |
68.3 |
64.8 |
2054 |
|
8 |
59 |
55.5 |
1249 |
|
47 |
36.2 |
34.5 |
340 |
|
86 |
92.4 |
89.2 |
5055 |
|
9 |
54 |
50.1 |
1203 |
|
48 |
30.5 |
28.3 |
160 |
|
87 |
76.2 |
73.4 |
2943 |
|
10 |
62.5 |
59 |
1581 |
|
49 |
35.5 |
33.4 |
270 |
|
88 |
74 |
72.1 |
2611 |
|
11 |
75.8 |
70.4 |
3500 |
|
50 |
33.7 |
29.4 |
259 |
|
89 |
37.6 |
33.6 |
314 |
|
12 |
77.5 |
73.2 |
3518 |
|
51 |
56.2 |
53.1 |
1083 |
|
90 |
67.4 |
65.3 |
2023 |
|
13 |
53.4 |
49.8 |
1014.2 |
|
52 |
48.6 |
45.5 |
528 |
|
91 |
76.5 |
72.7 |
3098 |
|
14 |
28.3 |
25.9 |
168.3 |
|
53 |
44 |
40.9 |
395 |
|
92 |
68.9 |
63.8 |
2000 |
|
15 |
36.4 |
33.5 |
322.1 |
|
54 |
31.8 |
27 |
256 |
|
93 |
63 |
59.5 |
2386 |
|
16 |
36.8 |
33.9 |
320.5 |
|
55 |
78.5 |
74 |
3693 |
|
94 |
85.9 |
81.6 |
4784 |
|
17 |
33.8 |
31 |
278.3 |
|
56 |
55.3 |
51.8 |
1012 |
|
95 |
79.9 |
76.9 |
3371 |
|
18 |
51.7 |
48.5 |
1076.8 |
|
57 |
89 |
86.2 |
3949 |
|
96 |
98.6 |
96.5 |
7065 |
|
19 |
75 |
72 |
3280 |
|
58 |
90 |
85 |
4560 |
|
97 |
64 |
61.6 |
1937 |
|
20 |
63 |
59.5 |
3518 |
|
59 |
80 |
77 |
3060 |
|
98 |
86.2 |
83.6 |
3489 |
|
21 |
64 |
60 |
1576 |
|
60 |
70.3 |
66.5 |
2080 |
|
99 |
63.3 |
59.7 |
1156 |
|
22 |
55.7 |
50.3 |
1102 |
|
61 |
74.6 |
68.4 |
2940 |
|
100 |
66.4 |
63.2 |
2000 |
|
23 |
49.3 |
44.2 |
783 |
|
62 |
42.1 |
39.9 |
440 |
|
101 |
96 |
92.4 |
5379 |
|
24 |
49.8 |
45.8 |
830.3 |
|
63 |
76.6 |
73.7 |
3260 |
|
102 |
61.4 |
58 |
1483 |
|
25 |
69.5 |
65.2 |
2115 |
|
64 |
89.8 |
85.2 |
4300 |
|
103 |
48.8 |
46 |
958 |
|
26 |
82 |
77.7 |
3930 |
|
65 |
87 |
84.2 |
3930 |
|
104 |
77.8 |
74.4 |
3183 |
|
27 |
36 |
34 |
290 |
|
66 |
46.2 |
43.3 |
700 |
|
105 |
93.1 |
89.3 |
4360 |
|
28 |
82.8 |
75 |
3715 |
|
67 |
68 |
61.7 |
1950 |
|
|
|
|
|
|
29 |
69.5 |
65.2 |
2115 |
|
68 |
75 |
68.4 |
3335 |
|
|
|
|
|
|
30 |
82 |
77.7 |
3430 |
|
69 |
63 |
57.5 |
1955 |
|
|
|
|
|
|
31 |
83 |
78.5 |
3198 |
|
70 |
58.5 |
53.8 |
2345 |
|
|
|
|
|
|
32 |
82.4 |
78 |
3110 |
|
71 |
53.4 |
50.3 |
870 |
|
|
|
|
|
|
33 |
75 |
69 |
3700 |
|
72 |
83 |
79 |
3500 |
|
|
|
|
|
|
34 |
93 |
86 |
5045 |
|
73 |
93 |
85.7 |
6100 |
|
|
|
|
|
|
35 |
34 |
31.5 |
200 |
|
74 |
88.4 |
81.4 |
4170 |
|
|
|
|
|
|
36 |
46.8 |
44 |
560 |
|
75 |
87 |
80.6 |
3950 |
|
|
|
|
|
|
37 |
34.5 |
32 |
250 |
|
76 |
78.8 |
70.8 |
3500 |
|
|
|
|
|
|
38 |
37.2 |
35.5 |
315 |
|
77 |
81.1 |
76.9 |
3200 |
|
|
|
|
|
|
39 |
53 |
50 |
770 |
|
78 |
85.3 |
81.2 |
3890 |
|
|
|
|
|
Tabella 4.2.2f - Lunghezze (cm) e pesi (gr) delle anguille.
ANGUILLA (Anguilla anguilla)
|
N°. |
L.T. |
PESO |
|
N°. |
L.T. |
PESO |
|
|
(cm) |
(gr) |
|
|
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
1 |
91.5 |
1614 |
|
33 |
79.3 |
802.2 |
|
2 |
79.8 |
1012.7 |
|
34 |
77 |
1110 |
|
3 |
62.8 |
446.3 |
|
35 |
81.2 |
1224 |
|
4 |
51.2 |
216.4 |
|
36 |
66.5 |
485.7 |
|
5 |
64 |
524.7 |
|
37 |
67 |
554.2 |
|
6 |
55 |
337.5 |
|
38 |
61.4 |
403.4 |
|
7 |
74 |
945 |
|
39 |
69 |
575.8 |
|
8 |
72 |
684.9 |
|
40 |
55,3 |
326.3 |
|
9 |
80 |
904 |
|
41 |
71.6 |
795 |
|
10 |
56 |
417.9 |
|
42 |
70.5 |
605 |
|
11 |
65 |
504 |
|
43 |
83.5 |
1135 |
|
12 |
71 |
838.7 |
|
44 |
79 |
935 |
|
13 |
71 |
601.6 |
|
45 |
80 |
1140 |
|
14 |
67 |
667.9 |
|
46 |
75 |
810 |
|
15 |
54 |
280.9 |
|
47 |
89 |
1395 |
|
16 |
67 |
1091.4 |
|
48 |
66.4 |
640 |
|
17 |
63 |
459.4 |
|
49 |
100 |
1885 |
|
18 |
67 |
542 |
|
50 |
87.4 |
750 |
|
19 |
59 |
424.2 |
|
51 |
80 |
935 |
|
20 |
82 |
1096.9 |
|
52 |
84 |
1375 |
|
21 |
67 |
659.7 |
|
53 |
86.5 |
630 |
|
22 |
60 |
376 |
|
54 |
59.3 |
445 |
|
23 |
60 |
442.6 |
|
55 |
89 |
1325 |
|
24 |
51 |
265.6 |
|
56 |
82.8 |
1110 |
|
25 |
61 |
438.5 |
|
57 |
72.2 |
680 |
|
26 |
44 |
148.5 |
|
58 |
58.5 |
335 |
|
27 |
42 |
120.9 |
|
59 |
63 |
545 |
|
28 |
41 |
114 |
|
60 |
69 |
675 |
|
29 |
59 |
381.5 |
|
61 |
76.4 |
545 |
|
30 |
46 |
207.9 |
|
62 |
89.2 |
965 |
|
31 |
41 |
122.5 |
|
63 |
73.8 |
839 |
|
32 |
32 |
65.2 |
|
64 |
70.5 |
786 |
Tabella 4.2.2f (continua) - Lunghezze (cm) e pesi (gr) delle anguille.
ANGUILLA (Anguilla anguilla)
|
N°. |
L.T. |
PESO |
|
N°. |
L.T. |
PESO |
|
|
(cm) |
(gr) |
|
|
(cm) |
(gr) |
|
|
|
|
|
|
|
|
|
65 |
62.1 |
507 |
|
99 |
57.3 |
448 |
|
66 |
67.9 |
717 |
|
100 |
73.3 |
843 |
|
67 |
55.5 |
424 |
|
101 |
81.5 |
1373 |
|
68 |
68.5 |
734 |
|
102 |
73.9 |
980 |
|
69 |
63 |
560 |
|
103 |
76.8 |
1370 |
|
70 |
52.5 |
300 |
|
104 |
77 |
1115 |
|
71 |
71 |
647 |
|
105 |
87.8 |
1504 |
|
72 |
68.4 |
611 |
|
106 |
80.9 |
1167 |
|
73 |
66.4 |
595 |
|
107 |
85.5 |
1135 |
|
74 |
72.6 |
979 |
|
108 |
79.5 |
1097 |
|
75 |
59.5 |
416 |
|
109 |
57.5 |
340 |
|
76 |
79.6 |
1042 |
|
110 |
60 |
320 |
|
77 |
65 |
424 |
|
111 |
44.6 |
151 |
|
78 |
65.7 |
513 |
|
112 |
64.5 |
530 |
|
79 |
73.8 |
819 |
|
113 |
67.8 |
542 |
|
80 |
72.3 |
748 |
|
114 |
62 |
438 |
|
81 |
65 |
555 |
|
115 |
42.1 |
141 |
|
82 |
63.6 |
504 |
|
116 |
60 |
460 |
|
83 |
56.6 |
413 |
|
117 |
61.8 |
496 |
|
84 |
66.8 |
653 |
|
118 |
68.5 |
648 |
|
85 |
86 |
1373 |
|
119 |
69.8 |
645 |
|
86 |
74.5 |
638 |
|
120 |
68.3 |
782 |
|
87 |
87 |
1302 |
|
121 |
73.3 |
838 |
|
88 |
86.6 |
1356 |
|
122 |
68.8 |
666 |
|
89 |
83.3 |
1170 |
|
123 |
89 |
1463 |
|
90 |
69 |
680 |
|
124 |
62.8 |
573 |
|
91 |
93 |
1879 |
|
125 |
60.1 |
425 |
|
92 |
77.2 |
938 |
|
126 |
72 |
824 |
|
93 |
77.8 |
1182 |
|
127 |
59 |
439 |
|
94 |
80.5 |
1133 |
|
128 |
72 |
822 |
|
95 |
73.5 |
929 |
|
129 |
55.8 |
337 |
|
96 |
80.8 |
1377 |
|
130 |
80 |
1170 |
|
97 |
76 |
966 |
|
131 |
67.8 |
507 |
|
98 |
57.4 |
347 |
|
|
|
|
Per l’esperimento sono state utilizzate 8 gabbie aventi le seguenti caratteristiche (Fig. 4.2.3):
2 gabbie metalliche sommerse, 2 x 2 m x 1 m h, costituite da un’intelaiatura con tubi in ferro 48 mm di Æ e spessore di 2.6 mm. Tutti i lati della gabbia sono stati delimitati da una rete di nylon ad alta tenacità con la maglia di 15 mm da nodo a nodo. Sul lato dorsale, circa al centro della rete, un’area di 70 x 70 cm è stata separata dal resto della rete, fungendo da sportello, per il carico e scarico dei pesci.
4 gabbie Float-laguna 2, con 2 m di Æ e 1h. La gabbia è composta da un collare di galleggiamento superiore composto da un singolo tubolare in HDPE PN6, di 110 mm Æ. La rete di nylon aveva una maglia di 15 mm da nodo a nodo.
2 gabbie Float-laguna 2, con 2 m di Æ e 2 h per lo stoccaggio.
Fig. 4.2.3 - Vasche galleggianti e vasca di fondo
Alcune ore prima dell’esperimento, tutti gli individui delle cinque specie sopra citate sono stati divisi per taglia (piccoli e grandi) e successivamente collocati in 8 gabbie (Fig. 4.2.4a). Per ogni specie di pesce sono stati isolati a caso 12 individui, rispettivamente 6 per ogni taglia, e messi nelle 2 gabbie di stoccaggio come lotto di controllo. Nelle restanti 6 gabbie (2 di fondo e 4 di superficie) le specie sono state suddivise in base alla taglia e successivamente trasportate nei rispettivi siti.
La situazione sperimentale è risultata quindi la seguente:
|
1. Gabbia di controllo |
Taglie piccole |
6 carassi, 6 carpe, 6 p.gatto, 6 siluri, 6 anguille |
|
2. Gabbia di controllo |
Taglie grandi |
6 carassi, 6 carpe, 6 p.gatto, 6 siluri, 6 anguille |
|
3. Gabbia di fondo (punto 0) |
Taglie piccole |
17 carassi, 8 carpe, 12 p.gatto, 7 siluri, 7 anguille |
|
4. Gabbia di fondo (punto 0) |
Taglie grandi |
14 carassi, 9 carpe, 29 p.gatto, 24 siluri, 33 anguille |
|
5. Gabbia (sup.) a 25 m |
Taglie piccole |
17 carassi, 8 carpe, 12 p.gatto, 7 siluri, 7 anguille |
|
6. Gabbia (sup.) a 25 m |
Taglie grandi |
13 carassi, 9 carpe, 25 p.gatto, 24 siluri, 33 anguille |
|
7. Gabbia (sup.) a 50 m |
Taglie piccole |
17 carassi, 8 carpe, 12 p.gatto, 7 siluri, 7 anguille |
|
8. Gabbia (sup.) a 50 m |
Taglie grandi |
13 carassi, 9 carpe, 25 p.gatto, 24 siluri, 32 anguille |
Le gabbie di controllo sono state collocate ben lontano dal punto dell’ energizzazione. Due gabbie di fondo sono state posizionate con la gru sul letto del fiume ad una distanza di 15 m dalla riva (Fig. 4.2.4b e c). Le 4 gabbie galleggianti sono state trasportate con la barca a distanze rispettivamente di 25 e 50 metri dalle gabbie di fondo (sito dello sparo), e legate a coppie con la corda a due boe (Fig. 4.2.4d).

Fig. 4.2.4a - Immissione di pesci nelle gabbie galleggianti

Fig. 4.2.4b - Discesa in acqua delle gabbie di fondo

Fig. 4.2.4c - Discesa in acqua delle gabbie di fondo

Fig. 4.2.4d - Posizionamento delle gabbie galleggianti
Per effettuare l'esperimento, l'air gun tramite il braccio della gru è stato immerso in acqua, a circa 2 m sopra le 2 gabbie di fondo (Fig. 4.2.4e, f). Dopo la energizzazione (2000 psi), le 2 gabbie di fondo e quelle galleggianti sono state riportate a riva con gli stessi mezzi descritti precedentemente. Al termine dell'esperimento, tutti i pesci (lotto di controllo e quelli sottoposti al rilascio di
energia) sono stati trasportati in appositi contenitori presso il Dipartimento, (Fig. 4.2.4g, h, i) dove sono stati collocati negli acquari preparati per il controllo a medio-lungo termine.
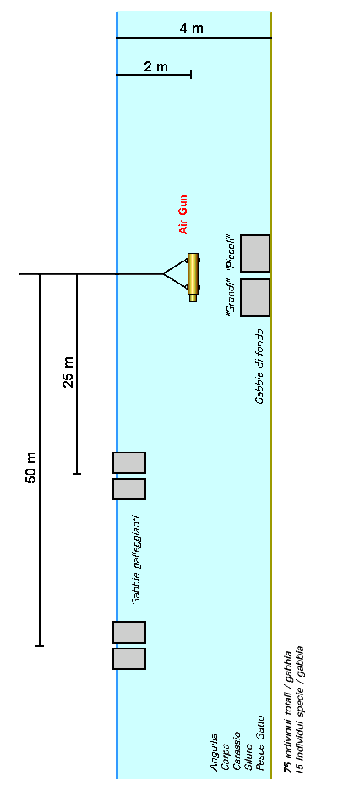



Fig. 4.2.4g e h - Prelievo dei pesci dalle gabbie dopo la prova

Fig. 4.2.4i - Prelievo dei campioni per le analisi di laboratorio
Per l'indagine istopatologica, dal lotto di controllo, immediatamente prima dell’esperienza sono stati prelevati con criterio casuale, e successivamente dissezionati, 20 individui, 2 per taglia e quindi 4 per ognuna delle 5 specie.
Per quanto concerne il gruppo dei pesci sottoposti alla energizzazione, l'esame ha interessato un totale di 156 esemplari, secondo lo schema sotto riportato.
|
Specie |
Taglia piccola |
Taglia grande |
Totale |
|
Carassio |
17 |
16 |
33 |
|
Carpa |
13 |
14 |
27 |
|
Pesce gatto |
15 |
16 |
31 |
|
Siluro |
18 |
16 |
34 |
|
Anguilla |
14 |
17 |
31 |
|
Totale |
77 |
79 |
156 |
Ogni esemplare destinato all’esame istopatologico è stato aperto ventralmente in senso postero-anteriore, dall'apertura anale fino a livello delle pinne pettorali, facendo attenzione a non danneggiare gli organi interni (Fig.4.2.5). Frammenti dei tessuti degli organi bersaglio sono stati fissati in Bouin. Dopo la disidratazione in serie ascendenti di alcool, i pezzi sono stati inclusi in paraffina e sezionati al microtomo. Le sezioni, di circa 7m di spessore, sono state quindi colorate con il metodo di Azan-Mallory.

Fig. 4.2.5 - Dissezione di un esemplare per l’esame istopatologico
La tabella 4.3.1 riporta il numero assoluto dei pesci morti al momento della energizzazione e nel periodo successivo, ed il valore percentuale progressivo, calcolato sul numero totale dei pesci oggetto dell’esperimento, cioè 469 esemplari (dai 529 totali sono dedotti i 60 di controllo). Al termine della esperienza sono morti 17 pesci (3.62%), di cui il 2.99% nelle gabbie del punto 0, e lo 0.64% in quelle a 25 m. Nessun esemplare è morto nelle gabbie di controllo ed in quelle poste a 50 m di distanza dalla energizzazione.
|
MESSI IN ESPERIMENTO |
|
|
|
|
|
TEMPO 0 g |
Controllo |
0 m |
25 m |
50 m |
|
|
60 |
160 |
155 |
154 |
|
MORTI |
|
|
|
|
|
a 7 gg |
0 |
7 |
0 |
0 |
|
Mortalità % da 0 a 7 gg |
0 |
4.375 |
0 |
0 |
|
RESTANO |
|
|
|
|
|
a 7 gg |
60 |
153 |
155 |
154 |
|
|
|
|
|
|
|
MORTI |
|
|
|
|
|
a 15 gg |
0 |
7 |
3 |
0 |
|
Mortalità % sul periodo 7-15 gg |
0 |
4.575163 |
1.935484 |
0 |
|
RESTANO |
|
|
|
|
|
a 15 gg |
60 |
146 |
152 |
154 |
|
Mortalità totale % |
0 |
8.75 |
1.935484 |
0 |
Tab. 4.3.1 - Mortalità osservata
Nel dettaglio, a 7 gg sono morti 7 pesci, di cui 3 carpe (1 piccola, 2 grandi); 2 carassi (grandi) e 2 pesci gatto (1 piccolo, uno grande). A 15 gg sono morti altri 10 pesci, di cui 5 carpe (2 piccole, 3 grandi), 2 carassi (grandi) e 3 pesci gatto (1 piccolo, 2 grandi). Il c2 di indipendenza, anche per la specie a più alta mortalità, la carpa, di cui sono morti 8 esemplari su 63 (51 esposti alla energizzazione, 12 di controllo) non risulta significativo: c2 = 1.83, P = 0.18%.
Al termine della prova, pochi minuti dopo l'emissione dell'aria compressa, i pesci sono stati osservati per diversi minuti in acqua, al fine di valutare gli effetti sul comportamento. Si è rilevata una depressione del sensorio (stordimento) da leggera a media, relazionata alla distanza dal punto di emissione dell’onda d’urto (air gun) e con una certa preferenza per i siluri di maggiore taglia. I pesci si sono comunque ripresi nel giro di pochi minuti (da 5 a 10), e non è stata registrata mortalità alcuna. Di seguito vengono riportati i dettagli clinico-necroscopici per le diverse gabbie.
I pesci di controllo, così come gli altri utilizzati nel corso della sperimentazione, si sono mostrati generalmente in buone condizioni di salute (Fig. 4.3.2.1a). All’osservazione macro- e microscopica non sono emerse lesioni di rilievo, in grado di inficiare i risultati della prova. Le scarse e lievi lesioni rilevate sono imputabili esclusivamente allo stato di confinamento di soggetti selvatici, e sono da considerarsi perfettamente reversibili. Di seguito queste ultime verranno definite col termine di “lesioni di fondo”, in modo da distinguerle chiaramente dalle lesioni più probanti di un danno da picco di sovrapressione. Per la descrizione macro- e microscopica delle ‘lesioni di fondo’ si riporta: alcune carpe hanno manifestato leggera iperemia e degenerazione branchiale, incipiente degenerazione epatica e modica congestione renale, mentre alcuni carassi mostravano prevalente degenerazione branchiale ed epatica; alcuni siluri presentavano risentimento epatico con aspetto marmorizzato, ed i pesci gatto leggera congestione renale. Le “lesioni di fondo” erano presenti anche nei pesci oggetto della sperimentazione, senza differenze significative fra i diversi lotti (Fig. 4.3.2.1b e Fig. 4.3.3e).
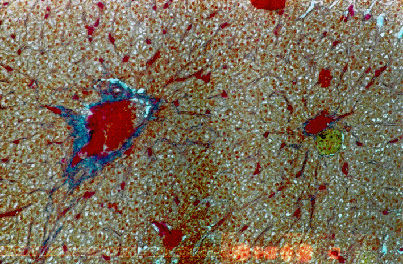
Fig. 4.3.2.1a - Anguilla di controllo. Fegato. Colorazione Mallory-Azan. Si nota la fisiologica infiltrazione di grasso degli epatociti tipica dei pesci ed un aggregato dei melano-macrofagi (giallo-bruno) nei pressi di un vaso

Fig. 4.3.2.1b - Anguilla. Gabbia superficie 50 m distanza. Vescica natatoria. Colorazione Azan-Mallory. Non si repertano lesioni
I pesci di questa gabbia sono stati i più esposti all’onda d’urto dell’air gun, ma hanno riportato danni lievissimi e reversibili, che hanno interessato un numero ridotto di esemplari.
In particolare in una carpa di lunghezza totale di 41 cm si è repertata una copiosa emorragia branchiale spontanea monolaterale appalesatasi nel corso della manipolazione. Sollevando l’opercolo branchiale ed esponendo le branchie in camera branchiale si notava una marcata degenerazione e congestione branchiale, sicuramente causa predisponente l’emorragia. Le rimanenti carpe manifestavano “lesioni di fondo”, con quadri di moderata congestione branchiale, incipiente degenerazione epatica, leggera congestione renale.
In un carassio di 35 cm di lunghezza totale è stata repertata una soffusione emorragica episclerale monolaterale (Fig. 4.3.2.2). Alcuni dei rimanenti carassi hanno presentato degenerazione branchiale ed un risentimento epatico di maggior grado, se rapportato alle carpe.
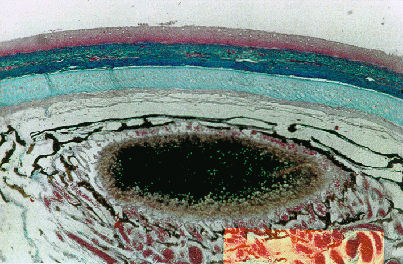
Fig. 4.3.2.2 - Carassio. Gabbia di fondo. Occhio. Colorazione Azan-Mallory. Sono evidenti soffusioni emorragiche a carico della congiuntiva episcelarale, in presenza di vasi coroidei integri
In un siluro di 79 cm di lunghezza totale si sono repertate minute petecchie emorragiche in posizione epicardica. Nei rimanenti siluri lievi degenerazioni branchiali si sono accompagnate ad un aspetto marmorizzato del parenchima epatico, segno di una epatosi incipiente.
I pesci gatto hanno manifestato “lesioni di fondo”, con modiche congestioni renali, e lievi degenerazioni branchiali.
Le anguille hanno mostrato una notevole refrattarietà all’onda d’urto, presentando solo modiche congestioni branchiali, e qualche lieve lesione alla vescica natatoria, ma imputabile alla presenza di occasionali parassiti (Anguillicola spp.).
In nessuno dei pesci si sono rilevati danni alle vesciche natatorie - ad eccezione di 3 anguille (per anguillicolosi, come già detto) - né danni alle superfici cutanee (emorragie) ed alla colonna vertebrale (fratture).
L’entità dello stordimento dei pesci è stata nettamente inferiore a quella dei pesci della gabbia di fondo. In riferimento alla distribuzione interspecifica delle lesioni repertate si è osservata una parziale corrispondenza con quanto osservato nella gabbia di fondo, ad eccezione della indipendenza dalla mole dei soggetti. Non si sono repertate emorragie a livello di superficie cutanea, ed oculare - ad eccezione di una leggera soffusione emorragica in un carassio - né a livello di organi interni. Le vesciche natatorie sono apparse integre ad eccezione di quelle di qualche anguilla risultata parassitata da nematodi del genere Anguillicola.
Anche in questa gabbia si sono repertate le “lesioni di fondo” riscontrate nei pesci delle gabbie di controllo ed in quelle di fondo.
Ad eccezione del fatto che l’entità dello stordimento è stata di grado inferiore a quanto registrato nei pesci delle precedenti gabbie (di fondo e a 25 m dall’air gun), le lesioni riscontrate nei pesci sono identiche a quelle precedentemente descritte per le altre gabbie galleggianti ed a quelle della gabbia di fondo, nonché nei controlli.
Di seguito verranno riportati per le singole specie oggetto della sperimentazione le lesioni precedentemente definite “di fondo” comuni ai diversi gruppi sperimentali, soffermandosi in modo particolare sulle lesioni riscontrate esclusivamente nei pesci delle gabbie di fondo, quindi più esposti all’onda d’urto, e maggiormente probanti di un danno indotto dall’air gun.
Nelle carpe, a livello branchiale, si è osservato un leggero stato degenerativo, accompagnato da moderata congestione lamellare. A livello epatico si è repertata una degenerazione idropico-vacuolare di modico grado. A livello renale è stata verificata una parziale congestione glomerulare, e blandi segni di nefrosi tubulare (Fig. 4.3.3a).
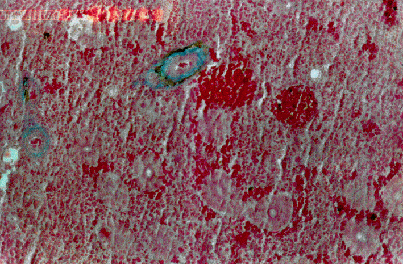
Fig. 4.3.3a - Carpa. Gabbia di fondo. Rene. Colorazione Azan-Mallory. Si repertano tubuli renali modicamente degenerati. La struttura è comunque integra
Nei carassi, a livello branchiale, si è osservata un marcato stato edematoso delle lamelle secondarie, con un incipiente stato di degenerazione idropica delle cellule epiteliali (Fig. 4.3.3b e Fig. 4.3.3c).

Fig. 4.3.3b - Carassio. Gabbia di superficie 25 m. Branchie. Colorazione Azan-Mallory. Si nota edema della lamella secondaria
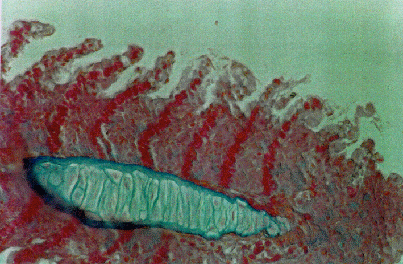
Fig. 4.3.3c - Carassio. Gabbia 25 m. Branchie. Colorazione Azan-Mallory. Particolare della precedente
A livello epatico si è osservato una notevole infiltrazione grassa del fegato, con focolai miliari di necrosi ed aspetto marcatamente vacuolizzato. A livello renale si sono notati i segni istologici di nefrosi tubulare, rappresentati da degenerazione e necrosi di alcuni elementi cellulari epiteliali e comparsa di detriti nel lume tubulare.
Nei siluri si è notato edema lamellare branchiale e l’aspetto marmorizzato epatico ha manifestato la sua controparte istologica in aree di degenerazione idropico-vacuolare inframezzate ad aree di parenchima integro, con modica congestione del sistema vasale portale.
Nei pesci gatto è stata registrata una degenerazione idropica delle lamelle branchiali con modica congestione lamellare. A livello epatico si è rilevata degenerazione idropica-vacuolare; a livello renale una discreta congestione dell’interstizio (Fig. 4.3.3d e Fig. 4.3.3e).
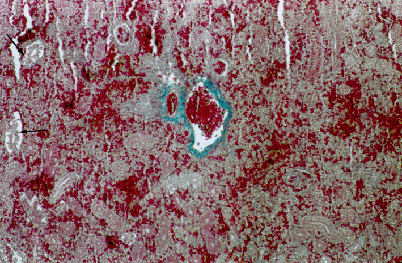
Fig. 4.3.3d - Pesce gatto. Gabbia di fondo. Rene. Colorazione Azan-Mallory. Si nota una modica congestione dell’interstizio renale con alcune soffusioni emorragiche. Sono visibili anche aggregati destrutturati di melano-macrofagi. Spiccano alcuni tubuli renali degenerati (frecce) ed alcuni glomeruli iperemici
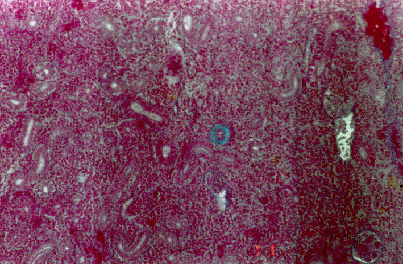
Fig. 4.3.3e - Pesce gatto. Gabbia di superficie 25 m. Rene. Colorazione Azan-Mallory. Non si evidenziano lesioni di rilievo
Le lesioni rilevate esclusivamente nei tessuti dei pesci maggiormente esposti agli effetti delle onde d’urto, (pesci della gabbia di fondo), spiccando sulle lesioni “di fondo” hanno mostrato una certa specificità per i siluri ed i pesci gatto, mentre risultano pressoché assenti nelle anguille.
Nei siluri della gabbia di fondo, con una maggiore frequenza per quelli di taglia maggiore, si sono notate petecchie e soffusioni emorragiche a carico dei vasi che vascolarizzano l’epicardio (Fig. 4.3.3f e Fig. 4.3.3g), struttura molto sensibile nei pesci dal momento che la cavità pericardica ittica è inestensibile al fine di migliorare la meccanica circolatoria e, verosimilmente, offre una resistenza maggiore, rispetto ad un tessuto elastico, all’attraversamento delle onde d’urto.
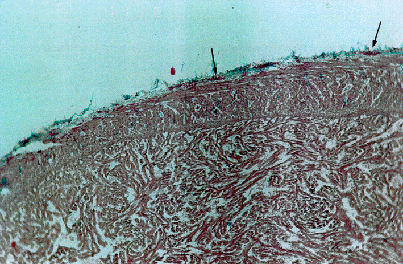
Fig. 4.3.3f - Siluro. Gabbia di fondo. Cuore. Colorazione Azan-Mallory. Si notano minute soffusioni emorragiche in sede epicardica (frecce)
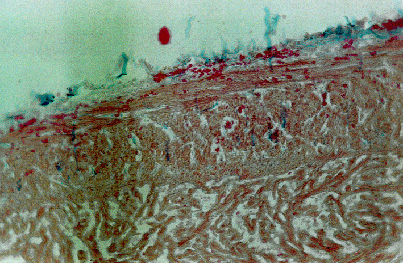
Fig. 4.3.3g - Siluro. Gabbia di fondo. Cuore. Colorazione Azan-Mallory. Particolare della precedente
Nei pesci gatto la lesione più appariscente è stata rappresentata da congestione renale di fondo e soffusioni emorragiche dell’interstizio renale. A motivo del reperimento di queste marcate lesioni a livello renale sono da sottolineare i rapporti intercorrenti tra cavità corporea, vescica natatoria e rene, e di come il rene dei pesci disponga di un sistema portale che drena il sangue refluo dalla regione caudale. Non da ultima è da considerare la conformazione del dorso dei pesci che, se sufficientemente largo, potrebbe agire nel senso di concentrare l’energia delle onde d’urto in posizione sottovertebrale, in analogia a quanto avviene nella patogenesi del trauma cranico.
Le soffusioni oculari nei carassi sono state repertate esclusivamente a livello episclerale, cioè di congiuntiva episclerale. In sezione le strutture oculari hanno manifestato la loro integrità, in modo particolare la coroidea, che nei pesci assume particolari aspetti e funzioni ed è spesso sede di emorragie, è rimasta insensibile all’onda d’urto dell’air gun.
Le scarse emorragie branchiali osservate traevano origine dalla dilatazione (telangectasia) e dalla rottura dei capillari delle lamelle secondarie branchiali. A questo proposito è importante sottolineare come notevoli sbalzi pressori - spesso la stessa cattura od i movimenti respiratori sincopati ne possono essere causa - rappresentino, congiuntamente ad un indebolimento dell’impalcatura branchiale (cellule epiteliali e pillarcells) , le cause scatenanti la telangectasia branchiale.
In termini di mortalità e di lesioni clinicamente e necroscopicamente rilevabili è stata notata una leggera prevalenza (7 individui totali) per i pesci maggiormente esposti alle onde d’urto (gabbie di fondo). I pesci maggiormente colpiti sono risultati i ciprinidi (carpa e carassio), ed i pesci gatto. I siluri non hanno manifestato postumi particolarmente evidenti, mentre le anguille hanno manifestato anche in questa occasione una certa refrattarietà (Fig. 4.3.4).
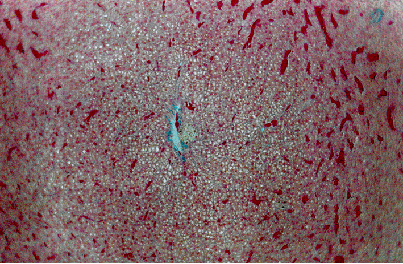
Fig. 4.3.4 - Anguilla. Gabbia di superficie 25 m. Fegato. Colorazione Azan-Mallory. Si nota una infiltrazione grassa centrolobulare e congestione perilobulare
Le lesioni rilevate sono da ascriversi a sovrainfezioni batteriche stress-indotte, e la loro gravità, e la loro distribuzione interspecifica - fatte salve le diversità tra le diverse specie - è risultato un buon indice dello stress “ambientale” subito dai pesci.
Quattro carassi sono risultati colpiti da forme blande di “malattia colonnare”, malattia sostenuta da batteri (Citophagacee) opportunisti, in grado di colonizzare lesioni traumatiche, abrasioni e/o branchie e cute integre in soggetti particolarmente stressati con elevati tassi di catecolamine ematiche e forme di ulcerosi cutanea, malattia batterica sostenuta da Aeromonas salmonicida, anch’essa a forte componente opportunistica. A livello istologico le lesioni “di fondo” risultavano particolarmente accentuate per i pesci malati (Fig. 4.3.4), paragonabili a subito dopo l’energizzazione per quelli risultati sani e vitali. Non si è notata comparsa o progressione alcuna di lesioni sugli organi bersaglio, ad eccezione di uno scadimento organico generale nei soggetti malati o morti.
In riferimento alle carpe sono state repertate in una modica percentuale (2%) di soggetti ulcerazioni cutanee sovrapponibile a quelle osservate nei carassi. A livello istologico le lesioni “di fondo” risultavano particolarmente accentuate per i pesci malati, paragonabili a subito dopo l’energizzazione per quelli risultati sani e vitali. Non si sono notate lesioni sugli organi bersaglio.
In riferimento ai pesci gatto sono stati repertati in una modica percentuale (3%) emorragie ed ulcerazioni cutanee, massiva degenerazione epatica, gastro-enterite catarrale e degenerazione-necrosi renale, ascrivibili ad una patologia batterica tipica dei pesci gatto sottoposti a stress, l’aeromonosi od aeromoniasi. A livello istologico le lesioni “di fondo” risultavano particolarmente accentuate per i pesci malati, paragonabili a subito dopo l’energizzazione per quelli risultati sani e vitali. Gli organi bersaglio sono risultati esenti da lesioni ad eccezione di tre soggetti malati.
In riferimento ai siluri sono state repertate rare e benigne lesioni cutanee ad eziologia batterica assimilabile a quelle rinvenute nei carassi. A livello istologico le lesioni “di fondo” risultavano particolarmente accentuate per i pesci malati, paragonabili a subito dopo l’energizzazione per quelli risultati sani e vitali. Non si è registrata comparsa o progressione alcuna di lesioni ad eccezione di danni al fegato e rene in 2 soggetti morti
In riferimento alle anguille, che insieme ai siluri hanno mostrato una maggior resistenza a lungo termine, registrando i postumi minori, sono stati repertati saltuari casi (1%) di peste rossa delle anguille, malattia batterica fortemente condizionata. Degno di nota è il fatto che non si sia registrata perdita alcuna tra le anguille. A livello istologico le lesioni “di fondo” risultavano particolarmente accentuate per i pesci malati, paragonabili a subito dopo l’energizzazione per quelli risultati sani e vitali. In 4 soggetti malati si sono riscontrate lesioni epatiche (Fig. 4.3.4).
Il quadro clinico dei pesci non è mutato di molto rispetto a 7 giorni prima. Dal settimo al quindicesimo giorno dopo l'esperimento, si è registrato un lieve aumento della mortalità (10 individui). Gli individui morti erano: 5 carpe, 2 carassi e 3 pesci gatto, rispettivamente 7 appartenenti alle gabbie di fondo e 3 alle gabbie di superficie (25 m dall'air gun). Indubbiamente tale aumento dovrà essere attribuito al prolungarsi del tempo di confinamento dei pesci. Sia nei pesci morti che in quelli vivi a lungo termine (15 giorni) si è potuto constatare lo stesso quadro macro-microscopico riportato in dettaglio precedentemente (7 giorni).
Per una corretta interpretazione delle lesioni macro- e microscopicamente evidenziate nei pesci oggetto della sperimentazione è fondamentale fare alcune premesse, in primo luogo riguardo lesioni definite “di fondo”. Qualsiasi organismo è in grado di mantenere il proprio equilibrio organico (omeostasi) al variare dei parametri ambientali. Questo compatibilmente con la propria anatomia, fisiologia, biochimica e sfruttando le potenzialità di bilanciamento e recupero caratteristiche di ogni specie. Di frequente, lesioni istopatologiche, anche di un certo rilievo, non danno adito ad alcun risentimento clinico. Ciò è dovuto alla capacità di riserva dell’organismo del pesce, ma, soprattutto alla reversibilità delle stesse lesioni, venute meno le cause che le hanno determinate (Hibiya, 1982; Ferguson, 1989). La cosiddetta reazione da stress rientra nell’esempio citato, e rappresenta una aspecifica risposta di qualsiasi vertebrato a generiche noxae patogene (Ferguson, 1989; Roberts, 1989). L’organismo reagisce iperattivandosi ed esasperando il proprio metabolismo, spesso a livelli critici. Se lo stimolo stressante è spropositato o perdura eccessivamente nel tempo, l’organismo travalica il punto di non ritorno e subentra il c.d. esaurimento. Ancora prima che questo sopraggiunga, l’animale si trova in una condizione molto critica, di forzato adattamento (sindrome di adattamento). L’organismo, al limite delle possibilità di compensazione, diventa suscettibile a tutta una serie di patogeni (virus, batteri, protozoi, metazoi) riuniti sotto il generico termine di opportunisti, perché approfittano della momentanea debolezza dell’ospite per prendere il sopravvento sui suoi meccanismi difensivi.
Le lesioni definite “di fondo” riscontrate più o meno nella maggior parte dei soggetti esaminati, controlli compresi, sono da considerare iniziali lesioni, completamente reversibili, tipiche di una reazione da stress (manipolazione, ipossia, ecc.), inevitabilmente indotta da qualsiasi tipo di sperimentazione che coinvolga soggetti selvatici. Il termine “di fondo” è stato scelto per sottolineare il fatto che facciano da sfondo alle lesioni ritenute specificatamente provocate dalle onde d’urto e probanti di un effetto biologico delle stesse.
Il fatto che a distanza di 7 gg. la situazione sia parzialmente precipitata per un numero limitato di esemplari della gabbia di fondo, sta a significare che tutti i pesci sono stati ugualmente sottoposti al medesimo evento stressante (sperimentazione) reagendo a seconda delle proprie capacità specifiche. Inoltre, i pesci prossimi al punto zero hanno subito una dose ulteriore di evento stressante rappresentato dalle onde d’urto, che possono aver indotto livelli terminali di stress molto elevati per alcuni soggetti sensibili per caratteristiche specifiche o individuali.
In conclusione, le osservazioni comportamentali, macro- e microscopiche consentono di affermare che gli effetti a breve termine sono risultati pressoché trascurabili e reversibili. Hanno interessato prevalentemente gli individui di grande taglia del siluro (per i più si è trattato esclusivamente di un leggero stordimento). Gli effetti a lungo termine sono risultati perlopiù dovuti dallo stress secondario da attribuire alla esposizione e le specie più suscettibili allo stress sono state la carpa, il carassio e il pesce gatto. Le anguille probabilmente, per il corpo cilindroide o per caratteristiche di specie, sono risultate praticamente refrattarie sia agli effetti a breve che a lungo termine. Il fatto che siano state utilizzate pesci selvatici (non domesticati) ha senza dubbio esasperato l’aspetto dello stress. In merito alle capacità reattive e di recupero, è fuori discussione che i pesci, nel loro ambiente naturale, sono maggiormente in grado di fronteggiare situazioni di stress passeggero, più di quanto possono fare pesci selvatici tenuti in condizioni di confinamento, seppur con tutte le precauzioni del caso. Inoltre in natura i pesci fuggono istintivamente le situazioni di pericolo reali o potenziali, cosa che non è permesso a pesci confinati e posti artificiosamente a distanze dall’air gun poco probabili nella pratica. Ciò significa che una estrapolazione dei dati emersi dalla presente sperimentazione, non può non considerare una modica sovrastima degli effetti, implicitamente connessa con il sistema sperimentale. In poche parole nelle condizioni pratiche di impiego ci si aspettano danni notevolmente inferiori a quelli già limitati e reversibili, osservati in questo esperimento.
La presente sperimentazioni ha quindi permesso di concludere che:
l'air gun non ha provocato alcuna mortalità e neppure gravi lesioni ai pesci;
gli effetti cronici manifestatisi a medio-lungo termine sono stati irrilevanti e dovuti allo stress secondario;
solo nei siluri di grande taglia è stata registrata una relazione diretta tra l'impatto dell'air gun (stordimento) e la taglia;
l'air gun ha indotto un leggero stordimento prevalentemente nei pesci (siluri) collocati nelle gabbie di fondo (2 metri sotto l'air gun);
i lievi danni verificatisi sono da porre in relazione alla distanza delle gabbie dalla sorgente d'emissione delle onde elastiche.